Contenidos
- COENZIMA .COM
- Tipos de coenzimas
- Funciones de las coenzimas
- Historia de las coenzimas
- Coenzimas y evolución
- Coenzimas NAD+ y NADH
- Coenzima A (CoA)
- Acido tetrahidrofolico (Coenzima F)
- Vitamina K
- Cofactor F420
- Adenosina trifosfato (ATP)
- S-adenosil metionina (SAM)
- Tetrahidrobiopterina (BH4)
- Coenzima Q10 (Ubiquinona)
- Glutatión
Otros sitios
Coenzimas NAD+ y NADH
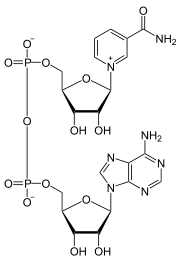 |
En el metabolismo, el NAD+ participa en las reacciones redox (oxidorreducción), llevando los electrones de una reacción a otra.
La coenzima, por tanto, se encuentra en dos formas en las células: NAD+ y NADH. El NAD+, que es un agente oxidante, acepta electrones de otras moléculas y pasa a ser reducido, formándose NADH, que puede ser utilizado entonces como agente reductor para donar electrones. Estas reacciones de transferencia de electrones son la principal función del NAD+. Sin embargo, también es utilizado en otros procesos celulares, en especial como sustrato de las enzimas que añaden o eliminan grupos químicos de las proteínas, en modificaciones post-traduccionales. Debido a la importancia de estas funciones, las enzimas que intervienen en el metabolismo del NAD+ son objetivos para el descubrimiento de medicamentos.
En los organismos, el NAD+ puede ser sintetizado desde cero (de novo) a partir de los aminoácidos triptófano o ácido aspártico. Alternativamente, los componentes de las coenzimas se obtienen a partir de los alimentos, como la vitamina llamada niacina. Compuestos similares son liberados por las reacciones que descomponen la estructura del NAD+. Estos componentes preformados pasan luego a través de una ruta que los recicla de vuelta a la forma activa. Algunos NAD+ también se convierten en nicotinamida adenina dinucleótido fosfato (NADP+), cuya química es similar a la de la coenzima NAD+, aunque tiene diferentes funciones en el metabolismo.
PROPIEDADES FÍSICAS Y QUÍMICAS
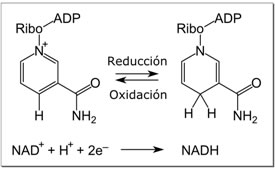 |
En el metabolismo, el compuesto acepta o dona electrones en las reacciones redox. Estas reacciones (que se resumen en la fórmula mostrada a continuación) implican la eliminación de dos átomos de hidrógeno del reactivo (R), en forma de ion hidruro, y un protón (H+). El protón se libera en solución, mientras que el RH2 se oxida y el NAD+ se reduce a NADH mediante la transferencia del hidruro al anillo de nicotinamida.
RH2 + NAD+ → NADH + H+ + R
Del par de electrones del hidruro, un electrón es transferido al nitrógeno cargado positivamente del anillo nicotinamida del NAD+, y el segundo átomo de hidrógeno es transferido al átomo de carbono C4 opuesto a este nitrógeno. El punto medio potencial del para redox NAD+ / NADH es -0,32 voltios, lo que hace al NADH un fuerte agente reductor. La reacción es fácilmente reversible, cuando el NADH reduce otra molécula y es re-oxidado a NAD+. Esto significa que la coenzima puede ciclar de forma continua entre las formas NAD+ y NADH sin que se consuman.
En apariencia, todas las formas de esta coenzima son polvos amorfos de color blanco, higroscópicos y muy solubles en agua. Los sólidos son estables si se conservan en seco y en la oscuridad. Las soluciones de NAD+ son incoloras y estables durante más o menos una semana a 4°C y pH neutro, pero se descomponen rápidamente en ácidos o álcalis. Cuando se descomponen, forman productos que son inhibidores de la enzima.
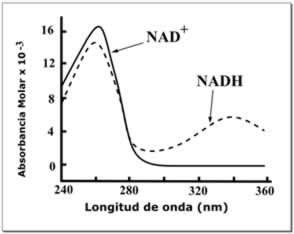 |
El NAD+ y el NADH también difieren en su fluorescencia. El NADH en solución tiene un pico de emisión a 460 nm y una vida útil de fluorescencia de 0,4 nanosegundos, mientras que la forma oxidada de la coenzima no fluoresce. Las propiedades de la señal de fluorescencia cambian cuando el NADH se une a las proteínas, por lo que estos cambios pueden ser utilizados para medir constantes de disociación, que son útiles en el estudio de la cinética de enzimas. Estos cambios en la fluorescencia se utilizan también para medir variaciones en el estado redox de las células vivas, mediante microscopía de fluorescencia.
CONCENTRACIÓN Y ESTADO EN LAS CÉLULAS
En el hígado de la rata, la cantidad total de NAD+ y NADH es de aproximadamente 1 μmol por gramo de peso fresco, unas 10 veces la concentración de NADP+ y NADPH en las mismas células. La concentración de NAD+ en el citosol de la célula es más difícil de medir, con estimaciones recientes en células animales que están en torno a 0,3 mM, y aproximadamente de 1,0 a 2,0 mM en la levadura. Sin embargo, más del 80% está enlazado a las proteínas, por lo que la concentración en solución es mucho más baja.
Los datos correspondientes a otros compartimentos de la célula son limitados, aunque en la mitocondria la concentración de NAD+ es similar al del citosol. Este NAD+ se transporta al interior de la mitocondria por una proteína de transporte específica de la membrana, ya que la coenzima no puede pasar a través de las membranas.
El equilibrio entre las formas oxidadas y reducidas de nicotinamida adenina dinucleótido se llama proporción NAD+/NADH. Esta proporción es un componente importante de lo que se llama estado redox de la célula, una medida que refleja tanto las actividades metabólicas como la salud de las células. Los efectos de la proporción NAD+/NADH son complejos, y controlan la actividad de varias enzimas, incluyendo la gliceraldehído 3-fosfato deshidrogenasa y la piruvato deshidrogenasa. En los tejidos sanos de mamíferos, la proporción NAD+/NADH es aproximadamente 1, por lo que la concentración de NAD+ y NADH son comparables. En contraste, la proporción NADP+/NADPH es normalmente de 0,005, unas 200 veces menor que la proporción NAD+/NADH. Por tanto, el NADPH es la forma dominante de esta coenzima. Las distintas proporciones son fundamentales para las diferentes funciones metabólicas del NADH y el NADPH.
BIOSÍNTESIS
El NAD+ se sintetiza a través de dos rutas metabólicas: en una ruta de novo a partir de aminoácidos, o en rutas de rescate mediante el reciclado de componentes preformados como nicotinamida convertida de nuevo a NAD+.
Producción de novo
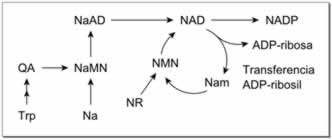 en los vertebrados. Las abreviaturas se definen en el texto. |
En un nuevo paso, algunos NAD+ se convierten en NADP+ mediante la NAD+ kinasa, que fosforila el NAD+. En la mayoría de los organismos, esta enzima utiliza ATP como fuente del grupo fosfato, aunque en las bacterias tales como Mycobacterium tuberculosis y en las arqueas como Pyrococcus horikoshii, el polifosfato inorgánico es una alternativa como donante de fosfato.
Rutas de rescate
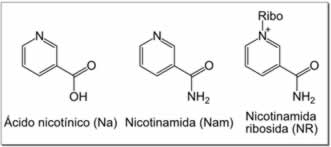 |
A pesar de la presencia de la ruta de novo, las reacciones de rescate son esenciales en los seres humanos. Una carencia de niacina en la dieta provoca una enfermedad llamada pelagra. Esta elevada exigencia de NAD+ resulta del constante consumo de la coenzima en reacciones como las modificaciones post-traduccionales, ya que el ciclado del NAD+ entre las formas oxidadas y reducidas en las reacciones redox no cambia los niveles generales de la coenzima.
Las rutas de rescate utilizadas por los microorganismos difieren de las de los mamíferos. Por ejemplo, algunos agentes patógenos, como la levadura Candida glabrata y la bacteria Haemophilus influenzae son auxótrofos de NAD+, es decir, no pueden sintetizar NAD+ y dependen de las rutas de rescate. Aún más sorprendente es el patógeno intracelular Chlamydia trachomatis, que carece de genes implicados en el rescate o en la biosíntesis de NAD+ y NADP+, y que en su lugar obtiene estas coenzimas de su anfitrión.
FUNCIONES
La nicotinamida adenina dinucleótido tiene varias funciones esenciales en el metabolismo. Actúa como coenzima en las reacciones redox, como donante de grupos ADP-ribosa en las reacciones de ADP-ribosilación, como precursor del segundo mensajero de la molécula cíclica de ADP-ribosa, así como sustrato para las ADN ligasas bacterianas y un grupo de enzimas llamadas sirtuinas, que usan NAD+ para eliminar los grupos proteícos acetilo.
Oxidoreductasas
La principal función del NAD+ en el metabolismo es la transferencia de electrones de una reacción redox a otra. Este tipo de reacción es catalizada por un gran grupo de enzimas llamadas oxidoreductasas. Los nombres correctos para estas enzimas contienen los nombres de sus sustratos: por ejemplo, la NADH-ubiquinona oxidoreductasa cataliza la oxidación del NADH por la coenzima Q. Sin embargo, estas enzimas son también conocidas como deshidrogenasas o reductasas, por lo que la NADH-ubiquinona oxidoreductasa también suele ser llamada NADH deshidrogenasa o, a veces, coenzima Q reductasa.
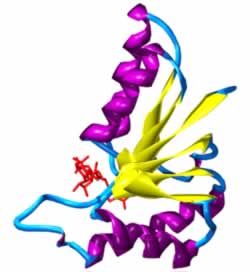 deshidrogenasa de Cryptosporidium parvum, con el NAD+ en rojo, las láminas beta en amarillo y las hélices alfa en púrpura. |
Cuando se enlaza al sitio activo de una oxidoreductasa, el anillo nicotinamida de la coenzima se coloca de modo que pueda aceptar un hidruro del otro sustrato. Ya que el carbono C4 que acepta el hidrógeno es proquiral, esto puede ser explotado en la cinética de enzimas para dar información sobre el mecanismo enzimático. Esto se hace mediante la mezcla de una enzima con un sustrato que tiene átomos de deuterio sustituidos por los hidrógenos, de tal forma que la enzima reducirá el NAD+ mediante la transferencia de un deuterio en lugar de un átomo de hidrógeno. En este caso, una enzima puede producir uno de los dos estereoisómeros de NADH. En algunas enzimas, el hidrógeno se transfiere desde el plano superior del anillo de nicotinamida (las oxidoreductasas clase A), mientras que en otras enzimas (las oxidoreductasas de clase B) la transferencia se produce desde abajo.
 |
Papel en el metabolismo redox
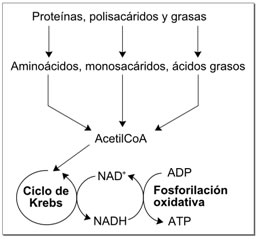 |
Dado que tanto las formas oxidadas como reducidas de nicotinamida adenina dinucleótido se utilizan en estos conjuntos de reacciones enlazadas, la célula mantiene aproximadamente concentraciones iguales de NAD+ y NADH. Una proporción alta de NAD+/NADH permite a este coenzima actuar como agente oxidante y como reductor. En contraste, la función principal del NADP+ es como agente reductor en el anabolismo, estando la coenzima implicada en rutas como la síntesis de ácidos grasos y la fotosíntesis. Dado que el NADPH es necesario para conducir las reacciones redox como un fuerte agente reductor, la proporción NADP+/NADPH se mantiene muy baja.
Aunque es importante en el catabolismo, el NADH se utiliza también en las reacciones anabólicas, como la gluconeogénesis. Esta necesidad de NADH en el anabolismo plantea un problema creciente para los procariotas que crecen en nutrientes que liberan sólo una pequeña cantidad de energía. Por ejemplo, las bacterias nitrificantes como Nitrobacter oxidan el nitrito a nitrato, lo que libera energía suficiente para bombear los protones y generar ATP, pero no la suficiente como para producir NADH directamente. Como el NADH sigue siendo necesario para las reacciones anabólicas, estas bacterias utilizan una nitrito oxidoreductasa para producir la suficiente fuerza motriz de protones como para ejecutar parte de la cadena de transporte de electrones en sentido inverso, generando NADH.
Funciones no redox
La coenzima NAD+ se consume también en las reacciones de transferencia de ADP-ribosa. Por ejemplo, las enzimas llamadas ADP-ribosiltransferasas añaden la fracción ADP-ribosa de esta molécula a las proteínas, en una modificación postraduccional llamada ADP-ribosilación. Esta reacción implica la adición de un solo grupo ADP-ribosa (mono-ADP-ribosilación), o la transferencia de ADP-ribosa a las proteínas en cadenas largas ramificadas (poli-ADP-ribosilación). La mono-ADP-ribosilación se identificó por primera vez como el mecanismo de un grupo de toxinas bacterianas, en particular la toxina del cólera, pero también participan en la señalización celular normal. La poli-ADP-ribosilación es llevada a cabo por las polimerasas poli-(ADP-ribosa). La estructura de poli-(ADP-ribosa) está implicada en la regulación de varios eventos celulares, y es más importante en el núcleo celular, en procesos como la reparación del ADN o el mantenimiento del telómero mantenimiento. Además de estas funciones dentro de la célula, se ha descubierto recientemente un grupo de ADP-ribosiltransferasas extracelulares, pero sus funciones aún no están claras.
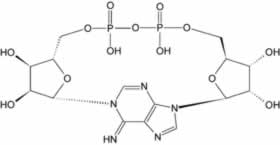 |
El NAD+ también es consumido por las sirtuinas, que son deacetilasas dependientes de NAD, como la Sir2. Estas enzimas actúan mediante la transferencia de un grupo acetilo de sus proteínas sustrato a la fracción ADP-ribosa del NAD+; esto rompe la coenzima y libera nicotinamida y O-acetil-ADP-ribosa. Las sirtuinas parecen estar implicadas en la regulación de la transcripción a través de histonas deacetilantes y alteración de la estructura del nucleosoma. Aunque las proteínas no histonas pueden ser desacetilizadas también por las sirtuinas. Esta actividad de las sirtuinas es especialmente interesante debido a su importancia en la regulación del envejecimiento.
Otras enzimas dependientes de NAD son las ADN ligasas bacterianas, que unen dos extremos de ADN mediante el uso de NAD+ como sustrato para donar un grupo adenosina monofosfato (AMP) al fosfato 5' de un extremo de ADN. Este intermediario es atacado luego por el grupo hidroxilo 3' del otro extremo de ADN, formando un nuevo enlace fosfodiéster. Esto contrasta con las ADN ligasas eucarióticas, que utilizan el ATP para formar intermediarios ADN-AMP.
FARMACOLOGÍA
Las enzimas que fabrican y usan NAD+ y NADH son importantes tanto en la farmacología actual como en la investigación de futuros tratamientos para las enfermedades. Las drogas de diseño y el desarrollo de medicamentos explotan el NAD+ de tres maneras:
a) como blanco directo de medicamentos;
b) mediante el diseño de inhibidores o activadores de la enzima basados en su estructura, que cambia la actividad de las enzimas dependientes de NAD+;
c) tratando de inhibir la biosíntesis de NAD+.
Actualmente, la coenzima NAD+ no se utiliza en sí misma como tratamiento para ninguna enfermedad. Sin embargo, es potencialmente útil en el tratamiento de enfermedades neurodegenerativas como el Alzheimer y la enfermedad de Parkinson. La evidencia de estas aplicaciones es mixta; los estudios en ratones son prometedores, mientras que un ensayo clínico controlado por placebo no demostró ningún efecto. El NAD+ es también un objetivo directo del medicamento isoniacida, que se utiliza en el tratamiento de la tuberculosis, una infección causada por la bacteria Mycobacterium tuberculosis. La isoniacida es un promedicamento, y una vez que ha entrado en la bacteria, se activa mediante una peroxidasa, que oxida el compuesto en forma de radical libre. Este radical reacciona entonces con el NADH, para producir aductos que son inhibidores muy potentes de las enzimas reductasas transportadoras de enoil-acil, y de la dihidrofolato reductasa.
Dado que un gran número de oxidoreductasas usan NAD+ y NADH como sustratos, y se enlazan a ellos mediante una forma estructural muy conservada, podría ser que los inhibidores basados en NAD+ sean específicos para cada enzima, algo que resulta sorprendente. Por ejemplo, los inhibidores basados en los compuestos de ácido micofenólico y tiazofurin inhiben la IMP deshidrogenasa en el sitio de unión del NAD+. Debido a la importancia de esta enzima en el metabolismo de las purinas, estos compuestos pueden ser útiles como anticancerígenos, antivirales o fármacos inmunosupresores. Otros fármacos no son inhibidores de la enzima, sino que activan las enzimas que participan en el metabolismo del NAD+. Las enzimas sirtuinas son un objetivo particularmente interesante para tales medicamentos, ya que la activación de estas deacetilasas dependientes de NAD+ extienden su vida útil. Los compuestos como el resveratrol aumentan la actividad de estas enzimas, lo que puede ser importante en cuanto a su capacidad para retrasar el envejecimiento, tanto en vertebrados como en invertebrados.
Debido a las diferencias en las rutas metabólicas de la biosíntesis de NAD+ entre diferentes organismos, como las bacterias y los seres humanos, este área del metabolismo es un sector prometedor para el desarrollo de nuevos antibióticos. Por ejemplo, la enzima nicotinamidasa, que convierte la nicotinamida en ácido nicotínico, es un objetivo en el diseño de medicamentos, ya que esta enzima no se da en los seres humanos pero está presente en levaduras y bacterias.
HISTORIA
La coenzima NAD+ fue descubierta por los bioquímicos británicos Arthur Harden y William Youndin en 1906, al observar que la adición de un extracto de levadura hervido y filtrado aceleraba en gran medida la fermentación alcohólica en extractos de levadura sin hervir. Al factor no identificado responsable de este efecto le llamaron cofermento. Hans von Euler-Chelpin, a través de una purificación prolongada y compleja de extractos de levadura, identificó este factor como un nucleótido azúcar fosfato. En 1936, el científico alemán Otto Heinrich Warburg demostró la función coenzimática del nucleótido en la transferencia de hidruro e identificó la porción nicotinamida como el lugar de las reacciones redox.
Una fuente de nicotinamida fue identificada en 1938, cuando Conrad Elvehjem purificó niacina a partir de muestras de hígado y demostró que esta vitamina contenía ácido nicotínico y nicotinamida. Luego, en 1939, Elvehjem proporcionó la primera evidencia sólida de que la niacina era utilizada para sintetizar NAD+. A principios de 1940, Arthur Kornberg hizo otra contribución importante para la comprensión del metabolismo del NAD+, siendo el primer científico en detectar una enzima en la ruta biosintética. Posteriormente, en 1949, los bioquímicos americanos Morris Friedkin y Albert L. Lehninger demostraron que el NADH estaba vinculado a rutas metabólicas como el ciclo del ácido cítrico con la síntesis de ATP en la fosforilación oxidativa. Por último, en 1959, Jack Preiss y Philip Handler descubrieron los intermediarios y enzimas que intervienen en la biosíntesis de NAD+; en consecuencia, la síntesis de NAD+ de novo a menudo se denomina ruta de Preiss-Handler en su honor.
Las funciones no-redox del NAD(P) son un descubrimiento reciente. La primera de estas funciones en ser identificada fue el uso del NAD+ como donante de ADP-ribosa en las reacciones de ADP-ribosilación observadas al comienzo de los 60. Más tarde, los estudios de los años 80 y 90 pusieron de manifiesto las actividades de los metabolitos NAD+ y NADP+ en la señalización celular, como por ejemplo la acción de la ADP-ribosa cíclica, que fue descubierta en 1987. El metabolismo del NAD+ sigue siendo un área de intensa investigación en el siglo 21, con un interés mayor después del descubrimiento en el año 2000 de unas enzimas deacetilasas dependientes de NAD+ llamadas sirtuinas, que fue llevado a cabo por Shin-Ichiro Imai y sus colaboradores en el Instituto de Tecnología de Massachusetts.
NADP+ y NADPH
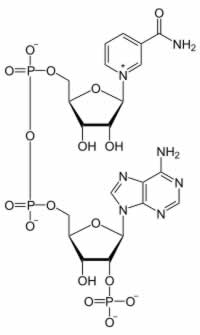 |
En las plantas
En los cloroplastos, el NADP se reduce mediante la enzima ferredoxina-NADP+ reductasa, en el último paso de la cadena de electrones durante las reacciones luminosas de la fotosíntesis. El NADPH producido se utiliza como poder de reducción para las reacciones de biosíntesis en el ciclo de Calvin de la fotosíntesis.
Los iones NADP en la fotosíntesis pueden considerarse como iones de hidrógeno 'arrastrados' (en los ciclos dependientes de luz), que se utilizan en los ciclos independientes de la luz (ciclo de Calvin) para producir carbohidratos.
En los animales
La fase oxidativa de la ruta de la pentosa fosfato es la principal fuente de NADPH en las células.
El NADPH proporciona los equivalentes reductores para las reacciones biosintéticas y de oxidación-reducción involucradas en la protección contra la toxicidad de las especies de oxígeno reactivas.
El NADPH se utiliza también en las rutas anabólicas, como la síntesis de lípidos, síntesis de colesterol y elongación de la cadena de ácidos grasos. Asimismo, es la fuente de equivalentes reductores en la hidroxilación de compuestos aromáticos, esteroides, alcoholes y otras sustancias.